 В качестве электрода сравнения (эталона), используется стандартный водородный электрод (свэ – электрод сравнения 1=го рода), который представляет собой платиновую пластинку, покрытую платиновой чернью, насыщенной газообразным водородом при давлении 1,01*105 Па (1 атм.), и погруженную в раствор, содержащий ионы H+ с активностью a=1. Схематически этот электрод можно записать в виде: Pt/H2(1,01*105 Па)/H+. (Рис. (9.3.5). На нем устанавливается равновесие:
В качестве электрода сравнения (эталона), используется стандартный водородный электрод (свэ – электрод сравнения 1=го рода), который представляет собой платиновую пластинку, покрытую платиновой чернью, насыщенной газообразным водородом при давлении 1,01*105 Па (1 атм.), и погруженную в раствор, содержащий ионы H+ с активностью a=1. Схематически этот электрод можно записать в виде: Pt/H2(1,01*105 Па)/H+. (Рис. (9.3.5). На нем устанавливается равновесие:
H+ + e- « 1/2 H2.
Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
Поскольку свэ является достаточно сложным устройством в лабораторных условиях чаще применяют более удобные в работе электроды сравнения второго рода, имеющие определенное и неизменяемое значение потенциала. Обычно пользуются хлорид-серебрянным и каломельным электродом (КЭ), состоящим из металлической ртути, хлорида ртути (каломели), находящейся в насыщенном растворе и 1 молярного раствора хлорида калия: Hg/Hg2Cl2/KCl. На электроде протекает следующая реакция:
Hg2Cl2 + 2е- = 2Hg + 2Cl-
Потенциал КЭ не зависит от концентрации ионов ртути, поскольку она очень мала и при работе ГЭ не изменяется. Значение потенциала КЭ при стандартных условиях: EКЭ = 0,2412 Ви практически не меняется в ходе проводимых измерений. Аналогичным электродом сравнения 2-го рода является и хлорид-серебрянный электрод, для которого характерно равновесие:
AgCl + е- « Ag + Cl-
Значение потенциала такого электрода EAgCl/Ag+Cl- = 0,224 В.
Определение электродных потенциалов металлов
Электродные потенциалы экспериментально определяют, измеряя напряжение гальванического элемента, составленного из исследуемого и электрода сравнения, потенциал которого известен. Схему элемента, в котором электродом сравнения является водородный электрод, записывают следующим образом: слева - водородный электрод, справа - измеряемый электрод.
Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
H2, Pt | H+ || Zn2+ | Zn,
а схема элемента для измерения потенциала медного электрода:
H2, Pt | H+ || Cu2+ | Cu,
напряжение гальванического элемента равно разности потенциалов правого и левого электродов:
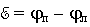
Так как потенциал левого электрода условно принимают равным нулю, то напряжение измеряемого элемента будет равно потенциалу правого электрода для водородно-цинкового элемента с обратным знаком:
DЕ = ЕH+/H0 - ЕZn2+/Zn0 –= 0,763 В,
т.е. водородный электрод будет катодом, а – цинковый анодом, во внешней цепи электроны будут перемещаются от цинкового электрода к водородному. Для медно-водородного электрода:
DЕ = ЕCu2+/Cu0 - ЕH+/H0 = 0,337 В,
медный электрод заряжен, относительно водородного, более положительно. Таким образом, во внешней цепи электроны перемещаются от водородного электрода к медному.
Теперь, зная потенциалы цинкового и медного электродов, можем рассчитать напряжение для элемента Даниэля-Якоби:
DЕ = ЕCu2+/Cu0 - ЕZn2+/Zn0 = + 0,337 –(-0,763) = 1,1 В,
Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
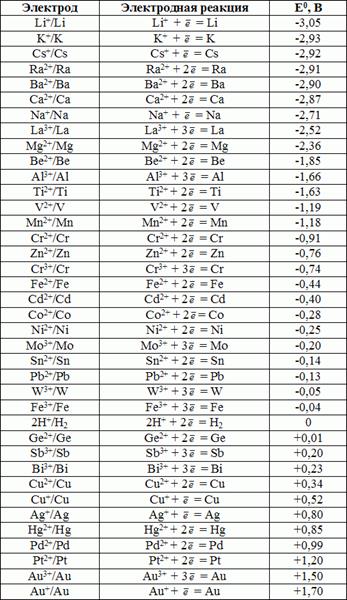
Стандартные электродные потенциалы металлических электродов в водных растворах приведены в справочной литературе. Величины стандартных ЭП металлов являются мерой восстановительной способности их атомов и мерой окислительной способности ионов металлов. Чем более отрицательное значение имеет потенциал системы Ме/Меn+, тем более сильной восстановительной способностью обладает атом. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Например, к наиболее сильным восстановителям (в водном растворе) относится литий (ЕLi+/Li0 = -3,04 B), а к наиболее сильным окислителям - ионы золота Au3+, Au+ (ЕAu3+/Au0 = +1,50 B, ЕAu+/Au0 = +1,69 B).
В таблице 9.1. приведены значения некоторых стандартных электродных потенциалов.
Полученный ряд значений получил условное название «ряд напряжений». В этом ряду металлы располагаются по мере уменьшения металлических свойств.
Таблица 9.1. Стандартные электродные потенциалы металлов.
Уравнение Нернста
Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях, можно рассчитать по уравнению Нернста:

где: φ - электродный потенциал окислительно-восстановительного электрода, В;
φ0 - стандартный электродный потенциал этого электрода, В, R - универсальная газовая постоянная, равная 8,314 Дж/моль· К, T – температура в K; n - число электронов в уравнении электродной реакции, F - число Фарадея, равное 96500 Кл/моль, aок., a восст. - активности окисленной формы восстановителя (Меn+) и восстановленной формы окислителя (Ме) в электродной реакции. Подставив в уравнение Нернста T = 298 K, R, F и введя множитель 2,3 (переход к десятичным логарифмам), получим:
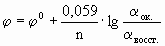
Уравнение Нернста для металлического электрода имеет вид:

Для разбавленных растворов, в которых активности мало отличаются от концентрации (a » С):

Величина j°Men+/Me0 называется стандартным ЭП металлического электрода. Значение ЭП металлического электрода равно величине стандартного ЭП металлического электрода при концентрации ионов металла в растворе, равной 1 моль/л. Стандартный электродный потенциал – равновесная разность потенциалов гальванического элемента, составленного из стандартного водородного электрода (электрод сравнения) и электрода, потенциал которого определяется в стандартных условиях.