Многообразие органических соединений в значительной мере обусловлено явлением изомерии.
Изомеры - соединения с одинаковым качественным и количественным составом, но отличающиеся последовательностью связывания атомов или расположением их в пространстве.
Стереоизомеры - изомеры, имеющие различное расположение атомов относительно друг друга в пространстве при одинаковой последовательности химических связей атомов. Стереоизомеры могут различаться конформацией и конфигурацией.
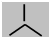 Конформациями называют различные пространственные формы молекулы, возникающие в результате вращения атомов или групп атомов вокруг одинарных связей. Конформационные изомеры легко превращаются друг в друга, образуя конфомеры. Для изображения конфомеров используются проекционные формулы Ньюмена, получающиеся при проецировании на плоскость молекулы вдоль С-С - связи. Ближайший к наблюдателю атом углерода обозначается точкой пересечения его связей , а удаленный от наблюдателя
Конформациями называют различные пространственные формы молекулы, возникающие в результате вращения атомов или групп атомов вокруг одинарных связей. Конформационные изомеры легко превращаются друг в друга, образуя конфомеры. Для изображения конфомеров используются проекционные формулы Ньюмена, получающиеся при проецировании на плоскость молекулы вдоль С-С - связи. Ближайший к наблюдателю атом углерода обозначается точкой пересечения его связей , а удаленный от наблюдателя
 |
атом углерода и его связи –
окружностью с линиями:
Рассмотрим крнформационные изомеры 1,2-этандиола:
стереохимическая формула:


заслоненный конформер заторможенный конформер

заслоненный конформер заторможенный конформер
Наиболее стабильными и энергетически выгодными конформерами являются заторможенные конформеры, в которых межатомное отталкивание наименьшее. Конформеры, в которых атомы или группы атомов расположены близко друг к другу, являются нестабильными и называются заслоненными. Переход одной конформации в другую осуществляется легко, и поэтому выделить конформеры в качестве устойчивых изомеров нельзя.
Конфигурации - это разные пространственные расположения атомов или групп атомов, которые не могут быть переведены друг в друга простым вращением вокруг связей.
Различают два вида конфигурационной изомерии: геометрическую (цис-транс) и оптическую изомерию. Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл.
Цис-изомером называют изомер, содержащий одинаковые заместители по одну сторону от плоскости двойной связи (цикла); транс-изомером - содержащий одинаковые заместители с противоположных сторон.
Геометрические изомеры отличаются друг от друга физическими и химическими свойствами, а также биохимической активностью.
Оптическая изомерия характерна для соединений, у которых в молекуле имеется асимметрический атом углерода, обозначаемый С* в Sp3-гибридизации, связанный с четырьмя различными атомами или группами атомов.
Для таких соединений характерно существование пространственных изомеров - энантиомеров, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
В отличие от геометрических изомеров, оптические изомеры обладают одинаковыми физическими и химическими свойствами. Различие между оптическими изомерами проявляется только по отношению к асимметрическим воздействиям. Одним из примеров такого воздействия является пропускание плоскополяризованного света через раствор органического соединения. Оптические изомеры вращают плоскость поляризации такого света в различные стороны на один и тот же угол. Изомер, вращающий плоскость поляризации вправо, обозначается буквой D, влево - буквой L. Смесь двух оптических изомеров в равных отношениях (рацемат) неспособна изменить плоскость поляризации света.
Многие вещества, синтезируемые в природе, обладают оптической активностью и часто представляют собой лишь один оптический изомер (например, α-аминокислоты). Большинство биологически активных веществ (в частности, некоторые лекарственные препараты) оказывают свое действие лишь при условии их применения в виде одного из оптических изомеров.
Для изображения энантиомеров на плоскости используются проекционные формулы Фишера.
· Асимметрический атом углерода помещают в точку пересечения горизонтальной и вертикальной линий и не обозначают символом.
· Углеродную цепь располагают вертикально таким образом, чтобы вверху находилась старшая группа.
· На горизонтальной линии располагают атом водорода и заместитель (гидроксильная группа, аминогруппа, галоген и т.п.).
Для отнесения право- и левовращающих энантиомеров к D- или L-ряду, за конфигурационный стандарт был принят глицериновый альдегид. Его право- и левовращающим энантиомерам были приписаны определенные конфигурации, обозначаемые D и L. Родственные D-глицериновому альдегиду энантиомеры относят к D-стереохимическому ряду. Функциональные группы при этом (OH, NH2, галогены и др.) в правильно написанной проекции Фишера располагаются справа от вертикальной линии. Соединения с противоположной конфигурацией асимметрического центра относят к L-ряду.
Например, для α-аминокислоты аланина:
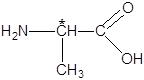
Проекционные формулы Фишера энантиомеров D- и L-ряда будут иметь вид:

Задание 3
1. Изобразите формулу Фишера: L-изомера, 2-амино -3-фенилпропановой кислоты
Образец выполнения:
а.) по названию строим структурную формулу органической молекулы и звездочкой обозначаем асимметрический атом углерода (sp3 – гибридизованный атом углерода, связанный с четырьмя различными атомами или группами атомов)

б.) Строим проекционную формулу Фишера: L-изомера (см. правила написания формул Фишера)

2. Изобразите формулу Фишера:
Д – изомера 2–гидрокси–3–меркаптопропаналя.
Образец выполнения:

| 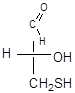
|
3. Напишите формулу цис-изомера 1, 2–диаминоэтена
Образец выполнения:

4. Изобразите формулу транс-изомера бутена – 2
Образец выполнения:
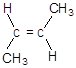
Задания № 3 контрольной работы
Вариант 1
1. Изобразите формулу Фишера Д-изомера 2-хлоргексановой кислоты.
2. Напишите формулу транс-изомера 1, 2–дигидроксиэтена.
Вариант 2
1. Изобразите формулу Фишера L-изомера 2-гидроксибутановой кислоты
2. Напишите формулу цис-изомера 1-амино-2-хлорэтена
Вариант 3
1. Изобразите формулу Фишера Д-изомера 2-йодпентандиовой кислоты
2. Напишите формулу транс-изомера 1, 2-димеркаптоэтена
Вариант 4
1. Изобразите формулу Фишера L -изомера 2-меркапто-3-аминопропановой кислоты.
2. Напишите формулу цис-изомера 1-нитро-2-бромэтена.
Вариант 5
1. Изобразите формулу Фишера Д-изомера 2-амино-3-бромпропановой кислоты
2. Напишите формулу транс-изомера 1-йодпропена.
