Наравне с заместительной номенклатурой используется радикально-функциональная. Данная номенклатура основана на выборе наиболее простого представителя гомологического ряда и последующего рассмотрения всего соединения в качестве производного этой исходной молекулы:

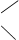 Н3С СН3 СН3
Н3С СН3 СН3
С = С │
Н3С СН3 СН3 – С – СН2 – СН2 – СН2 – СН3
тетраметилэтилен │
СН3 триметилбутилметан
Для соединений с функциональными группами перечисляют углеводородные радикалы и указывают класс соединения:
СН3 – ОН СН3 – О – С2Н5 Н5С2 – С – С2Н5
метиловый спирт метилэтиловый эфир ║
О
диэтилкетон
Если соединение симметрично, то перед названием ставят приставку ди- :
С6Н5 – С6Н5 (СН3)3 С – С (СН3)3 СН2 = СН – СН = СН2
дифенил дитретбутил дивинил
Наиболее древней является тривиальная номенклатура,в названиях которой обычно отражены способы получения веществ, их местонахождение, характерные свойства, области применения и т.д. Тривиальная номенклатура особо распространена среди веществ, встречающихся в природе, например: щавелевая кислота
анилин
никотиновая кислота
хлороформ
изопрен и т.д.
Правилами ИЮПАК разрешено употребление ряда тривиальных названий (бензол, пиридин, уксусная кислота и т.д.)
Задание 1
В приведенных органических соединениях подчеркнуть функциональные группы и определить:
а) тип углеродного скелета;
б) класс соединения;
в) дать название по заместительной номенклатуре
Образец выполнения:
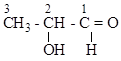
| а. ациклическое (алифатическое) насыщенное; б. спирт, альдегид; в. 2-гидроксипропаналь |
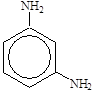
| а. карбоциклическое, ароматическое б. амин, карбоновая кислота в. 3-аминобензолкарбоновая кислота |
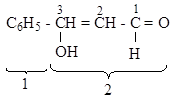
| а. карбоциклическое, ароматическое (по части 1) ациклическое, ненасыщенное, неразветвленное (по части 2) б. альдегид; в. 3-фенилпропен-2-аль |
Задания № 1 контрольной работы
Вариант 1
| 1. СН2 = СН – СООН 2. | 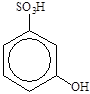
|  3 .О
СН3 – СН - СН = СН – С 3 .О
СН3 – СН - СН = СН – С
 Н
СН2СН3 Н
СН2СН3
| ||
Вариант 2
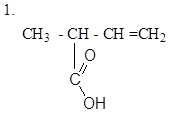
| 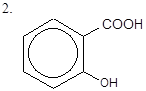
| 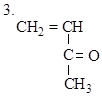
|
Вариант 3
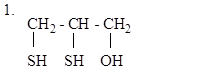
| 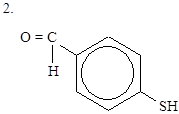
| 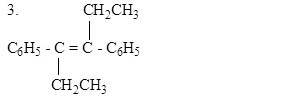
|
Вариант 4
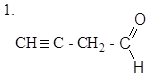
| 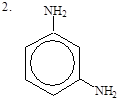
| 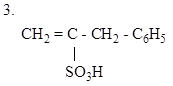
|
Вариант 5
| 1.НООС – СН = СН – СООН | 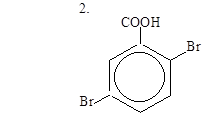
| 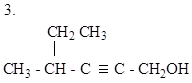
|
Сопряжение и ароматичность, электронные эффекты заместителей
Типы химической связи
1. Гетерополярная (электровалентная) связь или ионное взаимодействие
Характерна для соединений, в которых происходит полная отдача электрона одним атомом и приобретение его другим. При этом атомы превращаются в ионы с завершенными оболочками
Примеры гетерополярной связи в органической химии:
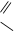 О
СН3 - С
О-К+
ацетат калия О
СН3 - С
О-К+
ацетат калия
| СН3 – О-Nа+ метилат натрия |
 НС С-Na+
ацетиленид натрия НС С-Na+
ацетиленид натрия
|
2. Гомеополярная (ковалентная) атомная связь
Образуется путем обобществления электронов. При этом химическая связь возникает за счет электронной пары, принадлежащей одновременно двум атомам
Различают два механизма образования ковалентной связи:
а. Коллигация(обменный механизм)
Каждый из атомов предоставляет по одному электрону в общее пользование.

Н3С×+ ×СН3 Н3С× СН3 СН3
б. Координация(донорно-акцепторный механизм)
Один из атомов (донор) предоставляет в общее пользование электронную пару, а другой (акцептор) имеет в своей оболочке вакантную орбиталь.
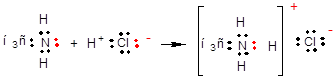
Взаимодействие метиламина с хлороводородом приводит к механизму координации
Метиламин – донор
Протон – акцептор
В хлориде метиламмония все N-H связи равны, отличие только в механизме образования.
В. Водородная связь
Относится к типу слабых взаимодействий. Возникает в случае, когда водород ковалентно связан с сильно электроотрицательным элементом (O, F, N).
Электронная плотность при этом значительно смещена к электроотрицательному атому и на водороде возникает частичный положительный заряд. При приближении к нему электроотрицательного атома другой молекулы между ними возникает сила притяжения.
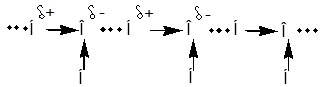
Водородная связь значительно слабее ковалентной. Тем не менее, она оказывает существенное влияние на физико-химические характеристики соединений: температуры кипения и плавления, растворимость в воде. Температура кипения спиртов повышается, т.к. требуется дополнительная энергия для разрушения водородных связей при переводе в парообразное состояние. Иногда образуются прочные ассоциаты, которые не разрушаются и при нагревании, существуя и в парах, например, димеры низших кислот.
 O … H – O
O … H – O
R – C C - R
O – H … O
Из всех известных видов слабых взаимодействий лишь водородные связи обладают требуемой прочностью, необходимой для поддержания высокоорганизованных молекулярных структур и вместе с тем допускают быстрые структурные перегруппировки при температурах, присущих живым организмам.
Т.к. в органических соединениях преобладает ковалентная связь, рассмотрим её более подробно:
Характеристики ковалентной связи:
1. Длина связи
- это равновесное расстояние между ядрами связанных атомов, выражаемое в нанометрах. Половина длины связи в симметричной молекуле (Н2, Сl2…) называется ковалентным радиусом.
1 нм = 10-9 м (нанометр)
2. Энергия связи Е [кДж/моль; ккал/моль]
- это энергия, выделяющаяся при образовании молекулы из одиночных атомов. Обычно чем длиннее связь, тем меньше её энергия.
3. Полярность (статическая поляризация)
- отражает взаимное влияние непосредственно связанных атомов. Ковалентная связь полярна в случаях, когда один из связанных атомов обладает большей ЭО Неполярная ковалентная связь образуется, когда в молекуле связаны два одинаковых атома и электронная плотность распределена равномерно между атомами.
d+ d-
 Н3С Сl
полярная связь Н3С Сl
полярная связь
| Н3С – СН3 неполярная связь |
4. Поляризуемость (динамическая поляризация)
- это способность электронной оболочки атома или молекулы деформироваться под воздействием внешнего поля, вызванного ионами или полярными молекулами. При снятии действия внешнего поля поляризуемость исчезает.
Поляризуемость связи возрастает с уменьшением разности ЭО атомов, образующих связь. Таким образом, существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше электроны сдвинуты в статической молекуле, тем меньше остается возможности для их смещения под внешним воздействием.
Подобная взаимосвязь хорошо прослеживается на примере молекул галогеноводородов:
НF HCl HBr HJ
 | |||
 |
полярности
поляризуемости
5. Направленность
Объясняется принципом максимального перекрывания атомных орбиталей. Нарушение этого принципа приводит к разрыву связи. Ковалентная связь тем прочнее, чем больше перекрывание электронных орбиталей при данном межъядерном расстоянии. Поэтому молекула, в которой ковалентной связью соединены более двух атомов, имеет определенное пространственное строение.
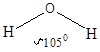
| 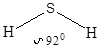
| 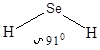
|
При образовании ковалентной связи различают два типа перекрывания атомных орбиталей. Если атомные орбитали перекрываются вдоль оси, соединяющей ядра атомов – это s-перекрывание (s-связь). Ковалентные p-связи образуются путем перекрывания р или d-орбиталей боковыми поверхностями. Чаще всего встречается p-связь, образованная боковым перекрыванием р-орбиталей с параллельными осями.
По прочности p-связь слабее s-связи.
6. Насыщаемость
Это свойство связано с тем обстоятельством, что в атоме в образовании связей участвуют неспаренные электроны и неподеленные пары электронов. Например, атом азота имеет три неспаренных электрона, а атом водорода – один. По принципу насыщаемости устойчивым соединением может быть только NH3.
